1.밀폐계에서의 열역학 제 1법칙
Q = ΔU + W
1)Q : 계에 공급된 열량 (공급 + // 방출 -)
2)ΔU : 계의 내부에너지 변화량 (증가 + // 감소 -)
3)W : 계가 한 일 (한다 + // 받는다 -)
4)미분형 : δQ = dU + δW = dU + PdV
2.단위 질량당의 밀폐계 열역학 제 1법칙
q = Δu + w
1) q : 단위질량당 계에 공급된 열량 (q = Q/m)
2) Δu : 단위질량당 계의 내부에너지 변화량 (Δu = ΔU/m)
3) w : 단위 질량당 계가 한 일 (w = W/m)
4)미분형 단위 질량당 열역학 제 1법칙
δq = du + δw = du + Pdv
3.엔탈피와 열역학 제 1법칙
3.1.엔탈피 H : 내부에너지 U + 유동일
H = U + PV
3.2.단위 질량당의 엔탈피 h = 단위질량당 내부에너지 u + 단위질량당 유동일 Pv
h = u + Pv
3.3.미분형 단위질량당의 엔탈피
dh = du + Pdv + vdP = δq + vdP
δq = dh - vdP =du + Pdv
4.비열과 비열비
4.1.정적비열과 정압비열
1)정적비열 Cv : 체적이 일정한 상태에서 단위질량의 기체를 단위온도만큼 올리는데 드는 열량
2)정압비열 Cp : 압력이 일정한 상태에서 단위질량이 기체를 단위온도만큼 올리는데 드는 열량

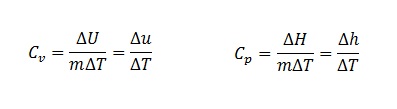

4.2.비열비
4.2.1.비열비 k : 정적비열과 정압비열의 비율 (Cp/Cv = 정압비열 / 정적비열)
4.2.2.이상기체의 비열비 k = Cp/Cv = (v+2/v)
1)v : 분자의 자유도 수로써 분자의 원자수에 따라 결정된다
2)단원자분자 : 헬륨/네온/아르곤 등의 단원자분자 => 유효한 운동은 (x,y,z축의 병진)운동, v=3
3)이원자분자 : 수소/질소/산소/공기 등의 이원자분자 => 유효한 운동은 (xyz병진운동)과 (y,z회전)운동, v=5
4)삼원자이상분자 : 이산화탄소,물등 삼원자 이상분자 => 유효한 운동은 (xyz병진,회전)운동, v=6
5)단원자분자 비열비 k = 5/3 = 1.67 이원자분자 비열비 k = 7/5 = 1.4 삼원자이상 분자 비열비 k = 8/6 = 1.33
6)비열비 k는 항상 1보다 크다 (k = Cp/Cv >1)

5.이상기체와 이상기체상태방정식
5.1.이상기체
1)이상기체 (ideal gas) : 완전가스(perfect gas)라고도 하며 이상기체상태방정식을 만족하는 기체
2)실제로 존재하지는 않으나 물리학적으로 기체를 다루는데 편리하고 표준이되는 기체
3)실제 기체중 압력이 매우 낮고 온도가 매우 높을경우 이상기체로 취급할 수 있다
5.2.이상기체상태방정식
1)보일-샤를의 법칙 : 기체의 온도/압력/부피와의 관계를 나타내는 법칙
1.보일의 법칙 : 기체의 온도가 일정하면 압력과 부피는 반비례한다
T=const => P∝1/V => P1V1 = P2V2
2.샤를의 법칙 : 기체의 압력이 일정하면 부피와 온도는 비례한다
P=const => V∝T => V1/T1 = V2/T2
3.보일-샤를의 법칙 : 기체의 부피는 압력에반비례하고, 절대온도에 비례한다
P1V1/T1 = P2V2/T2 =PV/T=const
2)이상기체상태방정식
PV = mRT Pv = RT P = ρRT
1. P : 압력 V : 부피 m : 질량 v : 비체적 ρ : 밀도 R : 기체상수
2. 기체상수 R : PV/T =일정에서 그 일정한 값으로 단위는 [kJ/kgK]이다 // 기체마다 값이 다르다
5.3.기체상수 R과 표준기체상수 R바
1)아보가드로법칙 : 모든기체는 같은온도/같은압력 하에서 같은 체적안에 같은 수의 분자 수를 같는다
표준상태(0℃ 1기압)에서 22.4L안에 1mol의 분자수 (1mol = 6.25 x 10^23)
2)표준 이상기체상태방정식 : 표준기체상수 R바를 사용한 이상기체상태방정식

3)P : 압력 / V : 부피 / n : 분자의 몰수 / R바 : 표준기체상수 / T : 절대온도
4)몰수 n : 기체의 질량을 분자량으로 나눈 값 / n = m/M
5)분자량 M : 분자의 단위몰수당 질량 // M = m/n
6)대표적인 원자의 분자량 : 수소H : 1 // 탄소(C) : 12 // 질소(N) : 14 // 산소(O) : 16
7)기체상수 R과 표준기체상수 R바와의 관계 : R = R바/M
8)표준상태조건을 이용하여 표준기체상수값 구하기 (0℃ 1기압에서 22.4L에 1mol의 분자수)

9)공기의 기체상수 R구하기 : 표준기체상수 R바를 공기의 분자량(약 29)로 나누어준다

6.비열의 차
1) 열역학 제 1법칙에서 δq = du + Pdv = dh - vdP에서 dh-du = Pdv + vdP = d(Pv) = d(RT) = RdT
2) dh = CpdT, du = CvdT에서 dh - du = dT(Cp-Cv) = Rdt에서 R = Cp - Cv
3) 비열비 k = Cp/Cv에서 Cp=kCv , Cp-Cv = R에서 Cv(k-1) = R , Cv = (1/K-1)R
4) Cp = kCv, Cv = (1/k-1)R에서 Cp = (k/k-1)R
'Dynamics & Math > Thermodynamics' 카테고리의 다른 글
| [열역학 6] 엔트로피의 계산과 무효에너지 (0) | 2023.07.15 |
|---|---|
| [열역학 5] 열역학 법칙과 카르노기관 (0) | 2023.07.15 |
| [열역학 4] 이상기체의 상태변화 (0) | 2023.07.15 |
| [열역학 2] 비열/열평형/열효율/일 등 (0) | 2023.07.15 |
| [열역학 1] 계와 기본용어 등 (0) | 2023.07.15 |



