1.이상기체의 상태변화
1.1.가역변화
1)정적변화 : 체적이 일정한 상태에서의 변화
2)정압변화 : 압력이 일정한 상태에서의 변화
3)등온변화 : 온도가 일정한 상태에서의 변화
4)단열변화 : 외부와의 열교환이 없는 상태에서의 변화
5)폴리트로프 변화
1.2.비가역변화
1)비가역 단열변화
2)교축변화
3)가스의 혼합
4)가스의 확산
2.가역변화
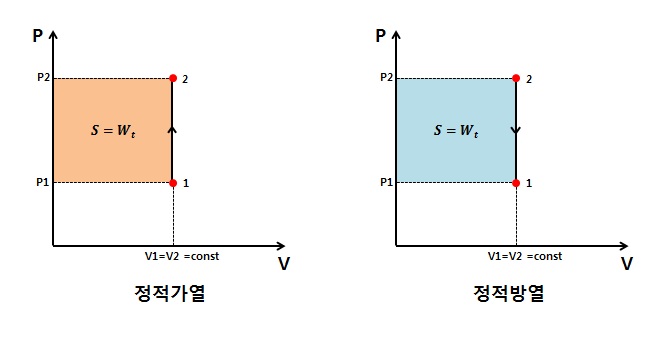
2.1.정적변화 (V = const / v = const / dV = dv = 0)
1)내부에너지 : du = CvdT => Δu=CvΔT = Cv(T2-T1) = (R/k-1)(T2-T1) = (1/k-1)(P2-P1)v
2)엔탈피 : dh = CpdT => Δh=CpΔT = Cp(T2-T1) = (kR/k-1)(T2-T1) = (k/k-1)(P2-P1)v
3)절대일 : W = 0 , δW = PdV = 0
4)공업일 : Wt = VdP = V(P2-P1) = VΔP // wt = vdP = v(P2-P1) = vΔP
5)열량 : δq = du + Pdv = du => Δq = Δu // 정적과정에서의 열량 = 내부에너지 변화량
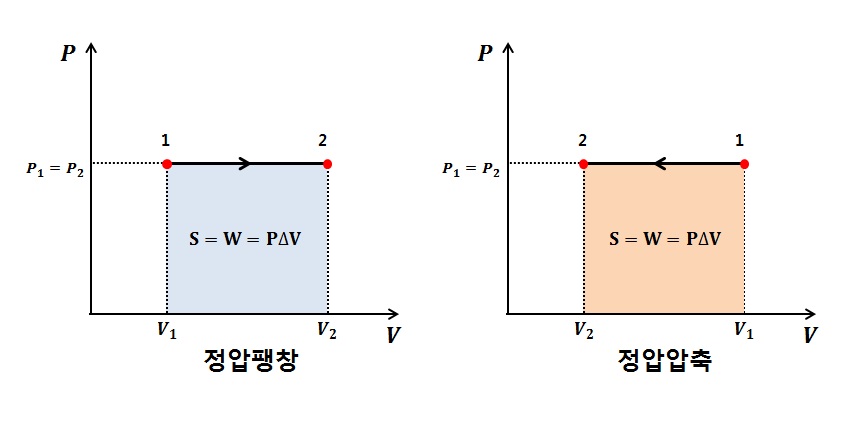
2.2.정압변화 (P = const // dP = 0)
1)내부에너지 : du = CvdT => Δu = CvΔT = (1/k-1)R(T2-T1) = (1/k-1)P(v2-v1)
2)엔탈피 : dh = CpdT => Δh = CvΔT = (k/k-1)R(T2-T1) = (k/k-1)P(v2-v1) = kΔu
3)절대일 : δw = Pdv => w = P(v2-v1) => W =PΔV
4)공업일 : δwt = vdP = 0
5)열량 δq = dh - vdP = dh // 정압과정에서의 열량 = 엔탈피의 변화량
2.3.등온변화 (T = const // dT =0)

1)내부에너지 : du = CvdT = Cv => Δu = CvΔT = u2-u1 = 0 => u1 = u2 = const
2)엔탈피 : dh =CpdT = Cp => Δh = CpΔT = h2 - h1 =0 => h1 = h2 = const
3)절대일 : δw = Pdv // Q = ΔU + W에서 Q = W // 등온과정에서 열량 = 절대일
4)공업일 : δwt = vdP // Q = ΔH + Wt에어 Q = Wt // 등온과정에서 열량 = 공업일
5)열량 : δq = dh - vdP = du + Pdv = -vdP = Pdv = δwt = δw => 등온과정에서 열량 = 절대일 = 공업일
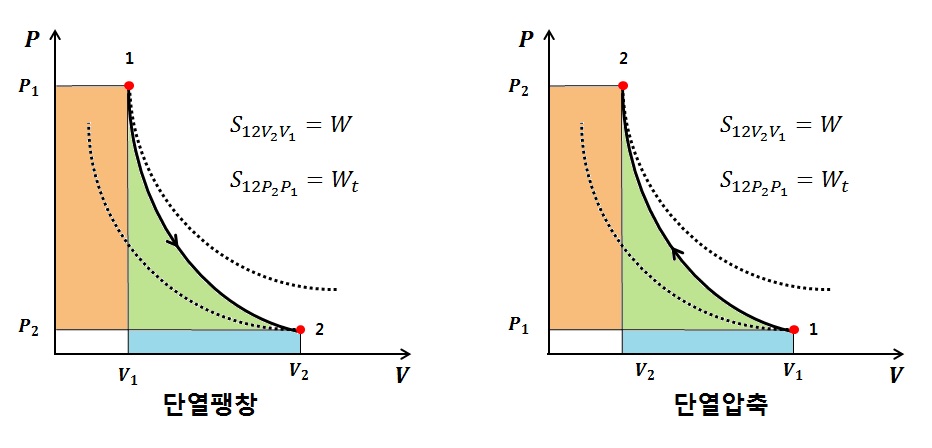
2.4.단열변화 (Q=0 // δQ = 0)
1)내부에너지 : δq = du + δw => du = -δw => Δu = -w
2)엔탈피 : δq = dh + δwt => dh = -δwt => Δh = -wt
3)절대일 : Q = ΔU + W => ΔU = -W => W = U1 - U2 => 단열상태에서 계가 팽창하면 내부에너지가 감소
4)공업일 : Q = ΔH + Wt => ΔH = -Wt => Wt = H1 -H2 => 단열상태에서 계가 팽창하면 엔탈피가 감소
5)열량 : Q = 0
8) 단열관계식 : PV^k = const , TV^(k-1) = const , T2/T1 = (V1/V2)^(k-1) = (P2/P1)^(k-1/k)
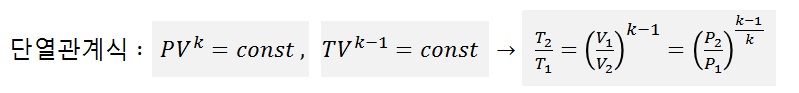
2.5.폴리트로프 변화 (단열관계에서 비열비 k 대신 폴리트로프 지수 n으로 치환)

1)정압과정에서의 n값 : PV^n = const, P = const => V^n = 1 => n = 0
2)등온과정에서의 n값 : PV^n = const, PV =mRT = const => V^n = V => n = 1
3)단열과정에서의 n값 : PV^n = const, PV^k = const => n = k
4)정적과정에서의 n값 : PV^n = const, V = const => PV^∞ = P^(1/∞)V = V => n = ∞
'Dynamics & Math > Thermodynamics' 카테고리의 다른 글
| [열역학 6] 엔트로피의 계산과 무효에너지 (0) | 2023.07.15 |
|---|---|
| [열역학 5] 열역학 법칙과 카르노기관 (0) | 2023.07.15 |
| [열역학 3] 열역학 제1법칙과 이상기체상태방정식 (0) | 2023.07.15 |
| [열역학 2] 비열/열평형/열효율/일 등 (0) | 2023.07.15 |
| [열역학 1] 계와 기본용어 등 (0) | 2023.07.15 |



